
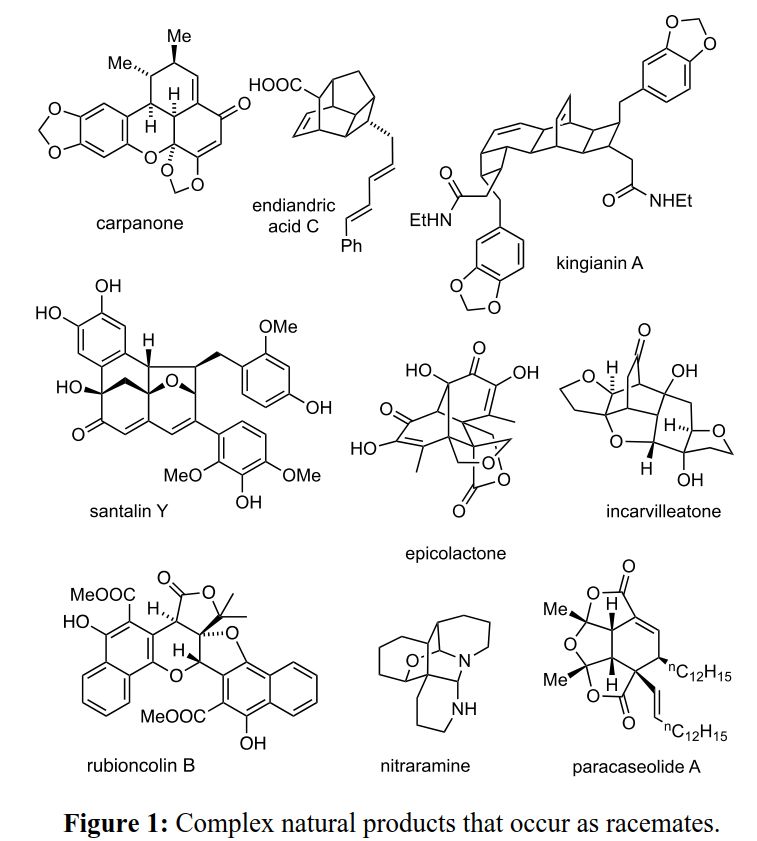
含多个立体中心和复杂分子拓扑结构的天然产物,引起了化学家们极大的兴趣。典型的化合物包括carpanone和endiandric acid,以及kingianin A、santalin Y、epicolactone、incarvilleatone、rubioncolin B、nitraramine和paracaseolide A等(Figure 1)。天然外消旋体可以由最初形成的非对称化合物逐渐发生外消旋化产生,或者由非酶催化、涉及非手性前体(如电环化和环加成)的反应产生,将这些反应合并到级联中可以进一步增加外消旋体的立体复杂性。上述所有天然产物Figure均涉及级联反应,并且都已通过仿生全合成得到了验证。
(图片来源:J. Am. Chem. Soc.)
Preuisolactone A是从内生真菌Preussia isomera中分离得到的一种外消旋天然产物,其三环[4.4.0.0]癸烷笼状骨架包含七个相邻的手性中心(其中两个是季碳手性中心)和两种丁内酯(一种乙烯基甲基酯和一种叔醇酯)。此外,该化合物显示出抗革兰氏阳性菌藤黄微球菌的活性,MIC值为10.2 μM,但对人癌细胞系无活性。近日,纽约大学Dirk Trauner课题组通过preuisolactone A的仿生全合成阐明了其来源,该成果发表于近期J. Am. Chem. Soc.(DOI: 10.1021/jacs.9b08892)。
从生物合成来看,作者认为preuisolactone A是由法尼基焦磷酸通过涉及萜烯环化酶和多个氧化步骤的复杂途径产生。尽管产生这两种对映体的萜烯环化酶已被广泛报道,但这种类似的氧化途径从未在同一生物体中被证实。
作者提出了另一种生物合成假说:preuisolactone A不是萜类化合物,而是聚酮类化合物,并且是通过邻苯二酚1与连苯三酚2的氧化二聚反应形成(Scheme 1)。其中,2是已知的真菌代谢物,其通过苔色酸的脱羧和氧化生物合成而来,而1可能源于这种原型聚酮化合物。1和2分别通过氧化产生邻苯醌3和羟基邻苯醌4,两者再经[5+2]环加成得到三环中间体5。这类反应在苯并噻唑啉酮类化合物的化学研究中具有很好的应用前景。最近,作者将其运用到了内酯类化合物的仿生合成中,其中还涉及merocytochalasans的生物合成。水分子进攻5的羰基桥,然后进行逆Dieckmann型裂解得到烯二酮6,其经插烯aldol加成得到三环中间体7。然后7通过氧杂Michael加成或Prins型机理进行氧化内酯化产生烯二醇8,再经氧化得到二酮内酯9。9由于其环张力作用而不发生烯醇化。最后,9经二苯乙醇酸重排、缩环,形成preuisolactone A的丁内酯或者叔醇。
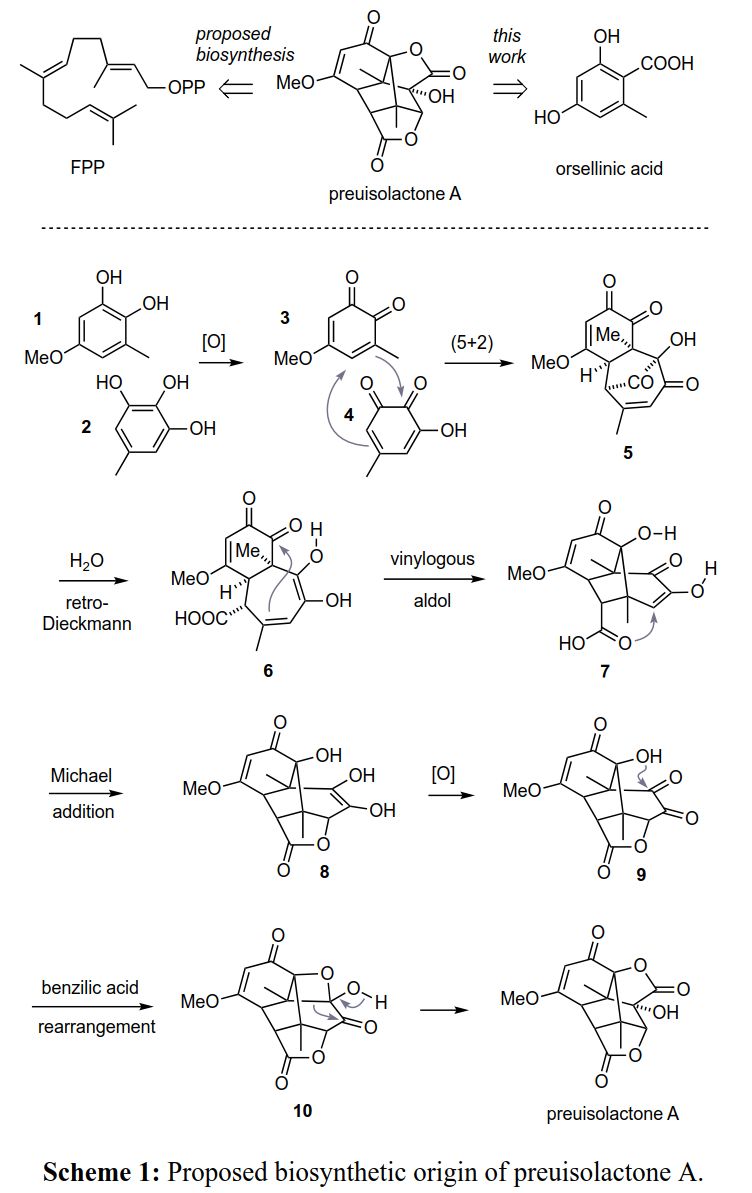
(图片来源:J. Am. Chem. Soc.)
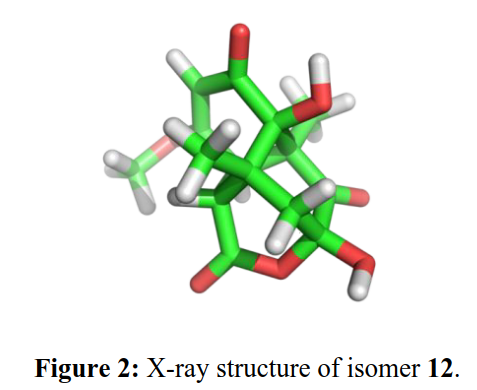
为了支持这一假设,作者用仿生全合成对其进行了验证(Scheme 2)。作者以已知的酚11为起始原料,经Dakin氧化得到儿茶酚1,然后将1与连苯三酚2在铁氰化钾存在下引发级联反应得到相互转化的异构体(7?12)混合物,并通过单晶X射线衍射确证了缩醛12的结构(Figure 2)。作者用K2CO3/CH3I处理混合物并分离得到甲酯和甲基烯醇醚14,证实了7的存在(Scheme 2,底部)。此外,作者还发现7与12的比例可以通过碱溶液处理后酸化进行调整,并且7的形成占优势。
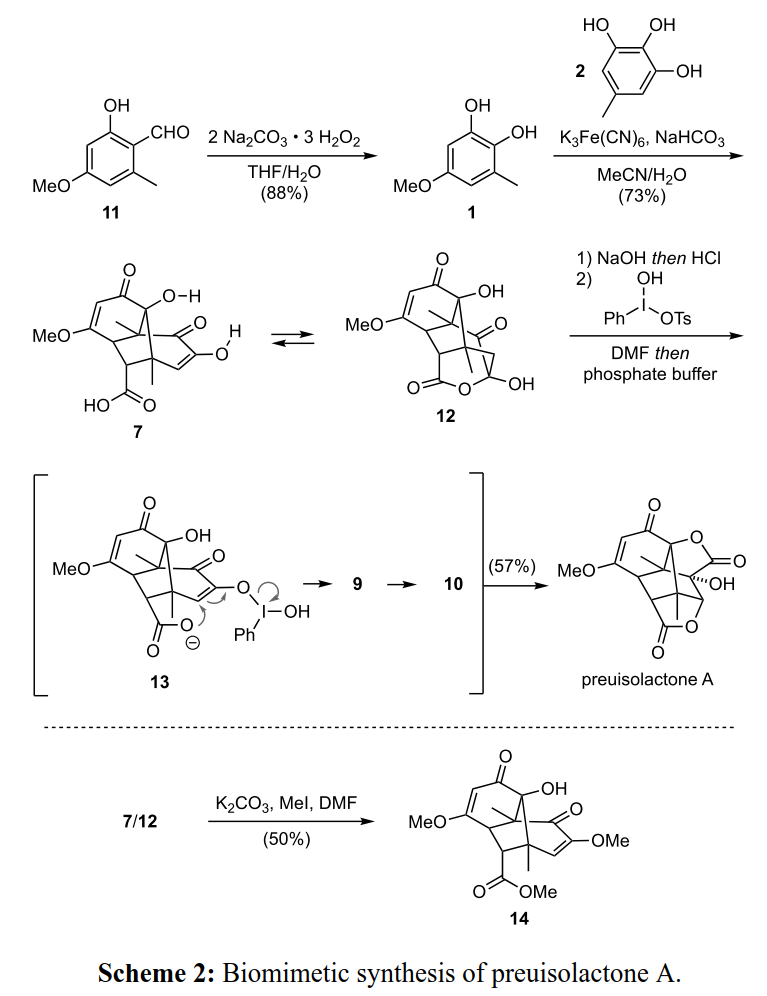
(图片来源:J. Am. Chem. Soc.)
(图片来源:J. Am. Chem. Soc.)
随后,作者用Koser试剂将7氧化形成内酯,得到的产物9不经分离直接在磷酸盐缓冲液(pH=8)中进行二苯乙醇酸重排得到preuisolactone A。值得注意的是,作者合成的起始原料均与天然产物相同。
结语:Dirk Trauner课题组报道了真菌代谢物preuisolactone A的简洁仿生全合成,其关键步骤包括[5+2]环加成、裂解、插烯aldol加成、氧化内酯化和二苯乙醇酸重排。此外,作者还解释了preuisolactone A以外消旋体被分离的原因,并指出其天然产物并非倍半萜,而是酚类聚酮。
原文(扫描或长按二维码,识别后直达原文页面):


●JACS:通过双重C(sp3)-H活化实现(-)-Epicoccin G和(-)-Rostratin A的多样性全合成
●Chem. Sci.:弗莱堡大学Bernhard Breit课题组实现铑催化的丙二烯的不对称分子内氢化
●Angew:加州大学Rychnovsky课题组完成(-)-Himeradine A的不对称全合成
●Angew:伊利诺伊大学Sarlah课题组实现钯催化的去芳构化顺式1,4-羟胺基化
●JACS:伊利诺伊大学David Sarlah课题组完成异臭椿烷型三萜的全合成

