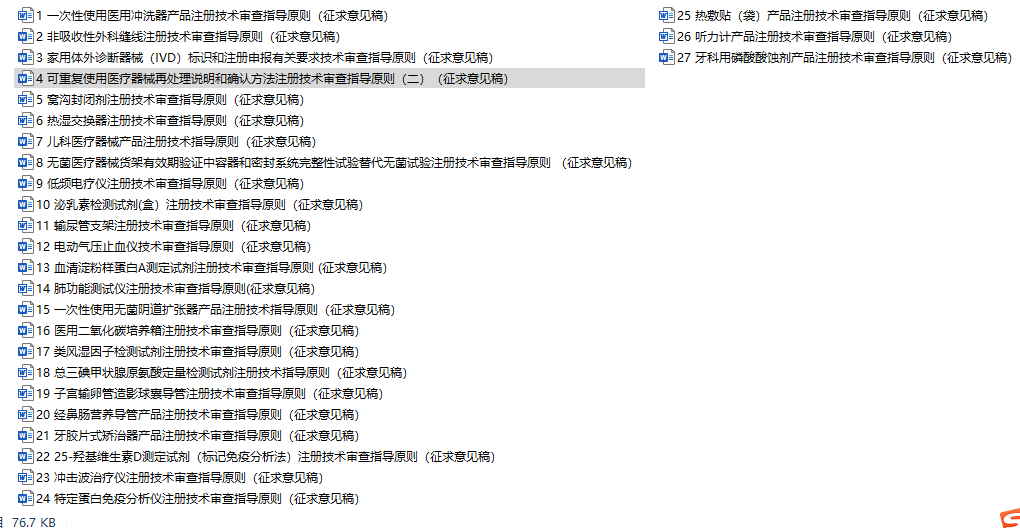
根据国家药品监督管理局2019年度医疗器械注册技术审查指导原则项目计划的有关要求,医疗器械技术审评中心组织编制了《一次性使用医用冲洗器产品注册技术指导原则》等27个二类指导原则(附件1),现已形成征求意见稿,即日起在网上公开征求意见。其中,由天津市医疗器械技术审评中心牵头承担编制的可重复使用医疗器械再处理说明和确认方法注册技术审查指导原则(二)(征求意见稿)顺利发布。
该指导原则由国家药监局医疗器械技术审评中心、辽宁省药械审评与监测中心、浙江省医疗器械审评中心等专家,以及奥林巴斯、卡尔史托斯、贝朗、新华医疗和史赛克等知名企业代表共同编制,作为国内检验实验室服务领域唯一入选代表,海河参与编制工作并积极分享了重复使用器械再处理确认试验的成功经验。

海河标测作为国内领先的第三方独立生物医药(药品、医疗器械、药品包装材料和医疗器械包装材料)检验实验室,于2018年获得CMA资质认定,同时具备CNAS、ANAB认证,并符合FDA GLP(21 CFR Part 58)要求,获授权的承检范围包括生物相容性测试、动物实验、特殊过程确认及微生物测试、ISO18562系列标准等,是中国唯一获得CNAS及CMA资质认定可以进行可重复性使用医疗器械清洗消毒确认的检测机构。

可重复使用医疗器械再处理说明和确认方法注册技术
审查指导原则(二)(征求意见稿)节选
本指导原则旨在指导注册申请人提交可重复使用医疗器械再处理说明和确认方法的申报资料,同时规范可重复使用医疗器械再处理有关内容的技术审评要求。本指导原则是对可重复使用医疗器械再处理说明和确认方法的一般性要求,注册申请人应根据医疗器械产品特性提交相应的申报资料,判断指导原则中的具体内容是否适用,不适用内容详述理由。注册申请人也可采用其他满足法规要求的替代方法,但应提供详尽的研究资料和验证资料。本指导原则是在现行法规和标准体系以及当前认知水平下、并参考了国外法规、指南、国内外标准和技术规范等制定的。随着法规和标准的不断完善,以及认知水平和技术能力的不断提高,相关内容也将适时进行修订。本指导原则是对注册申请人和审评人员的指导性文件,不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。
适用范围本指导原则适用于可重复使用的医疗器械,主要包括以下三种情形:(一)最初以无菌形式提供给用户,并且要求用户在首次使用后、后续患者再次使用前,进行再处理(即清洁、消毒或灭菌)的可重复使用医疗器械。(二)最初以非无菌形式提供给用户,并要求用户进行处理(即清洁、消毒或灭菌)以供首次使用,并在每次使用后需进行再处理的可重复使用医疗器械。(三)仅由单个患者使用,并且预期在每次使用之间需进行再处理的可重复使用医疗器械。以非无菌形式提供,并要求用户在使用前进行处理的一次性使用的医疗器械可参照本指导原则中适用的部分。此外,按照本指导原则中的再处理说明的要求可能不足以杀灭朊病毒,申请人应提醒用户按照其他相关规定对预期可能与朊病毒接触的器械进行处理。 注册申报资料要求本指导原则未提及的注册申报资料应符合《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》的要求。可重复使用医疗器械再处理说明中的内容都应经过确认。再处理说明的确认方案和报告应在产品申报资料研究资料的“灭菌/消毒工艺研究”中提供。对于列入附录《应提供再处理说明确认方案和完整试验报告的产品列表》表1中的软性内镜类产品以及具有表2中设计特征的表1中产品在注册申报时应按照本指导原则要求提供完整的再处理说明确认方案及确认报告;对于未列入列表中的产品也可按照本指导原则要求执行,同时在注册申报时若有其他法规、规范性文件规定或在审评时认为需要提供完整的再处理说明确认方案及确认报告的,也应提供相应的资料。(一)清洁确认方案的要求清洁确认方案应至少包含以下内容:1. 基本信息a) 试验产品信息明确产品的名称、型号规格、适用范围、结构组成等。如注册单元中包含多个型号,应说明所选取的典型性试验产品的型号以及选择的依据;b) 清洁类型应说明本次确认的清洁类型:手动和/或自动。清洁类型应覆盖说明书中提供的清洁类型;c) 清洁工具如果申请人提供的,用于本产品特定的清洁工具,应提供完整的清单以及其作用;d) 清洁剂应列明本次试验所使用的清洁剂,包括名称,类型,如适用,生产商及相关的许可证编号。清洁剂应能代表说明书中指定的清洁剂的类型,应对选择的清洁剂进行论证。e) 清洁机如果清洁类型为自动清洁,请列名确认适用的清洁机的名称、型号、生产商以及医疗器械注册证编号。2. 污染a) 人造污染物应指定人造污染物的成分,包括所有的组份以及每一个组份的浓度。人造污染物应能代表试验产品在试剂临床使用过程中接触的物质,并且应最难以清洁。不建议使用微生物作为污染物,因为微生物标记物不能代表有机污染物的清洁效果。申请人应提供人造污染物选择的论证。b) 污染部位应指定污染部位,污染部位应为产品最难以清洁的部分。如果有多个与人体接触的部位,建议污染所有的部位。申请人应提供污染部位选择的论证。c) 污染方式应说明如何使用人造污染物对试验样品进行污染的过程。3. 组别设置应设置试验样品组、阴性产品对照组、阳性产品对照组、阴性样品对照组和阳性样品对照组。对照组的制备应符合本指南清洁过程确认部分3.b的要求。应明确每个组别设置的具体方式,包含样本量。4. 清洁方法应明确常规清洁方法和确认用清洁方法。确认用清洁方法应采用最短时间、最低温度、最弱的稀释度等最不利的条件进行。方案应对常规清洁方法与确认用清洁方法对比,说明并论证其差异。常规清洁方法应与说明书的清洁方法保持一致。5. 确认过程a) 应明确确认的详细过程;b) 应明确污染物残留的收集方式;c) 应对污染物残留的收集方式进行确认;d) 应明确污染物残留的检测指标;e) 应明确污染物残留检测指标的测试方法;f) 应对测试方法进行方法确认。6. 评价方法应明确结果的计算方式以及针对指定的污染物残留检测指标,建立接受准则。申请人应论证接受准则的合理性。(二)消毒确认方案的要求消毒确认方案应至少包含以下内容:1. 基本信息a) 试验产品信息明确产品的名称、型号规格、适用范围、结构组成等。如注册单元中包含多个型号,应说明所选取的典型性试验产品的型号以及选择的依据;b) 消毒类型和消毒等级应说明本次确认的消毒类型:手动和/或自动,化学和/或热力学消毒;消毒类型覆盖说明书中提供的清洁类型和消毒等级;c) 消毒工具如果申请人提供的,用于本产品特定的消毒工具,应提供完整的清单以及其作用;d) 消毒剂应列明本次试验所使用的消毒剂,包括名称,类型,等级(高效,中效或低效),如适用,生产商及相关的许可证编号。消毒剂应能代表说明书中指定的消毒剂的类型,应对选择的消毒剂进行论证。e) 消毒机如果消毒类型为自动消毒,请列名确认适用的消毒机的名称、型号、生产商以及医疗器械注册证编号。2. 接种a) 菌种的选择应指定确认过程中使用的菌种。菌种应为对所选择的消毒类型和/或消毒剂等级最具挑战。申请人应提供菌种选择的依据。b) 接种部位应指定接种部位,接种部位应为产品最难以消毒的部分。如果有多个与人体接触的部位,建议接种所有的部位。申请人应提供接种部位选择的论证。c) 接种方式应说明如何使用微生物对试验样品进行接种的过程。3.组别设置应设置试验样品组、阴性产品对照组、阳性产品对照组、阴性样品对照组和阳性样品对照组。对照组的制备应符合本指南清洁过程确认部分3.b的要求。应明确每个组别设置的具体方式,包含样本量。4.消毒方法应明确常规消毒方法和确认用消毒方法。确认用消毒方法应采用最短时间、最低温度、最弱的稀释度等最不利的条件进行。方案应对常规消毒方法与确认用消毒方法对比,说明并论证其差异。常规消毒方法应与说明书的消毒方法保持一致。5. 确认过程a) 应明确确认的详细过程;b) 应明确微生物的收集方式;c) 应对微生物的收集方式进行确认;d) 应明确微生物定量分析的检测方法;e) 适当时,说明中和方法,并对中和方法进行确认;f) 适当时,应包括消毒剂残留评价。6. 评价方法应明确结果的计算方式,建立接受准则。申请人应论证接受准则的合理性。(三)灭菌确认方案的要求灭菌确认方案应至少包含以下内容:1. 基本信息a) 试验产品信息明确产品的名称、型号规格、适用范围、结构组成等。如注册单元中包含多个型号,应说明所选取的典型性试验产品的型号以及选择的依据;b) 灭菌方法应说明本次确认的灭菌方法;灭菌方法应覆盖说明书中提供的灭菌方法;c) 灭菌器请列名确认使用的灭菌器的名称、型号、生产商以及医疗器械注册证编号。灭菌器应为医疗机构可使用的灭菌器。2. 确认过程灭菌确认过程应遵循适当的国家或者行业标准。(四)确认再处理方法时的典型性产品选择如设计、材料和其它因素相似,可建立产品族(例如具有一系列可用尺寸的器械组),以尽量减少再处理的确认工作。也就是说,产品族中最难再处理的器械的确认数据(即,最不利情况下的器械或“主器械”)可涵盖再处理难度等同或再处理更容易的器械。如果采用了这种方法,则应评价在产品族中再处理较容易的器械的所有设计特征,例如与典型代表器械的再处理挑战相关的管腔长度和直径、材料、结构和质地,并确保其与典型代表器械再处理相比挑战性较小。任何可能影响灭菌剂渗透或效力的设计或材料的变化都可能导致需要进行重新确认。如果使用了典型代表器械,则应记录相关正当理由的支持性信息。 附录 应提供再处理说明确认方案和完整试验报告的产品目录序号产品名称1气管镜管、小儿支气管内窥镜2超声电子气管镜3内窥镜细胞刷、内窥镜活检刷、内窥镜细胞活检刷、一次性使用内窥镜用取样刷4内窥镜异物钳5内窥镜刮匙6内窥镜抓钳、内窥镜组织抓钳、内窥镜活检钳、内窥镜活组织检查钳、内窥镜取样钳、内窥镜组织检查钳7吸引管、一次性使用无菌吸引管8食道镜、纤维食道镜9鼻内窥镜、鼻窦镜、电子鼻咽喉内窥镜10儿童喉镜系统、喉镜、咽喉镜、纤维鼻咽喉镜、电子喉镜11胸腔镜12电子十二指肠镜13电子膀胱镜、电子十二指肠镜、电子胃镜14小肠胶囊内窥镜系统15内镜清洗消毒器、内镜清洗消毒系统16胆道镜、纤维胆道内窥镜、电子胆道镜17乙状结肠内窥镜、直肠内窥镜、纤维结肠镜、电子小肠镜系统、电子大肠镜、电子结肠镜18纤维上消化道镜、电子胃镜19膀胱镜、纤维尿道膀胱镜、膀胱电切内窥镜、电子膀胱肾盂镜20输尿管镜、纤维输尿管肾镜21超声电子气管镜、超声电子上消化道内窥镜、超声电子胃镜22脊柱外科内窥镜、颈椎内窥镜、腰椎间盘镜、椎间孔镜、椎间盘镜23关节镜24腹腔镜、电子胸腹腔镜25膀胱电切内窥镜、前列腺电切内窥镜
【声明】部分内容和信息来源于互联网,不代表本公众号赞同其观点和对其真实性负责。如转载内容涉及版权等问题,请立即与我们联系(400-821-7661),我们将迅速采取适当措施。