▼更多精彩推荐,请关注我们▼文章信息
标题:Enzymatic Intermolecular Hetero-Diels?Alder Reaction in the Biosynthesisof Tropolonic Sesquiterpenes
DOI:10.1021/jacs.9b06592
接收时间:2019.06.26
发表时间: 2019.08.08
期刊:JACS
影响因子:14.695文章作者

K. N.Houk
加利福尼亚大学洛杉矶分校(University of California, LosAngeles),美国艺术与科学学院(AAAS)院士,国际量子分子科学学院院士。
研究方向:1:周环反应机制,速率,动力学及基准计算方法2:探索酶催化和异常高亲和力结合物的起源
个人主页:http://www.chem.ucla.edu/houk/

胡友财研究员
北京协和医学院药物研究所研究员,博士生导师。科技部中青年科技创新领军人才,国家优秀青年科学基金获得者,北京协和医学院“协和学者”特聘教授,天然药物活性物质与功能国家重点实验室课题组长。迄今在 Nature Chemical Biology, Journal of American Chemical Society,Angewandte Chemie International Edition, Organic Letters 等国际著名期刊发表研究论文 50 余篇。参与编写专著6部,获教育部自然科学奖一等奖 1 项,2016 年获中国医学科学院第三届院校科技奖-青年创新奖。
研究方向:
基因-化学-功能导向的真菌活性天然产物的发现真菌活性天然产物的生物合成和合成生物学 个人主页:http://www.imm.ac.cn/cn/teacherinfo.asp?rstid=1271
▍研究背景
Diels-Alder(狄尔斯-阿德尔)反应,又名双烯加成反应,是一个 1,3-二烯与亲二烯体(烯烃或炔烃)反应生成环己烷的反应,该反应具有立体选择性,立体专一性,区域选择性。目前已经被报道的分子内 D-A 环化酶有 LepI, SpnF, PyrE3, IccD, PvhB 等,但是分子间 D-A 环化酶被报道的比较少。
目前已经发现的混源萜类中的 tropolone-倍半萜家族包括 neosetophomone B(1),epolone B (2), eupenifeldin (3) 和pycnidione 等,他们被推测是由杂原子 D-A 反应得到的。这类倍半萜的结构特点是中心有一个 11 元的大环,其两侧是一个或两个与 tropolone 偶联的二氢吡咯烷酮。
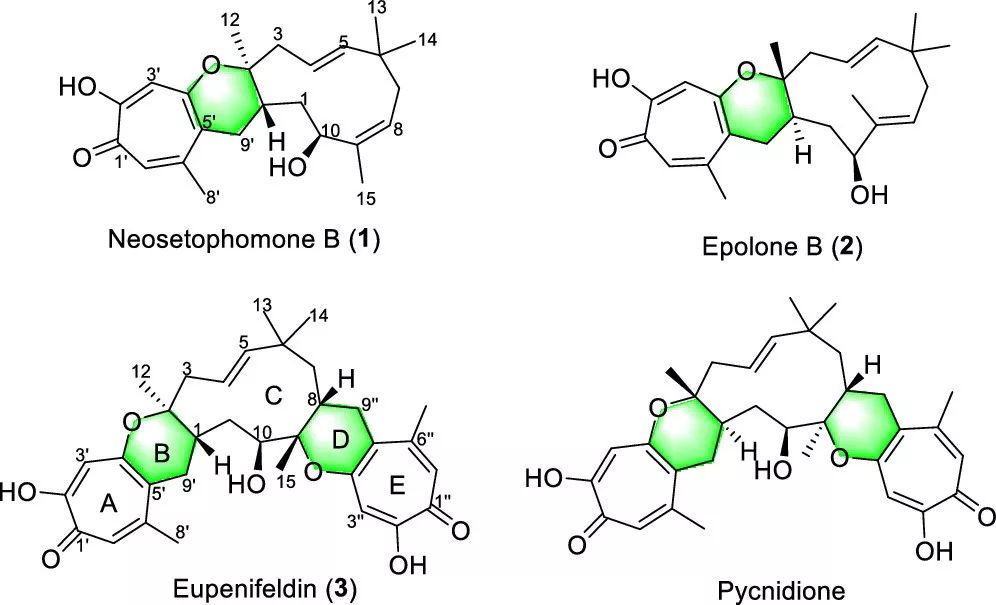
图1. 典型的对tropolone-倍半萜类化合物
近日,北京协和医学院药物研究所胡友财课题组与加州大学洛杉矶分校 K. N. Houk 课题组合作 JACS 期刊发表了题为“Enzymatic Intermolecular Hetero-Diels?Alder Reaction in the Biosynthesis of Tropolonic Sesquiterpenes”的研究论文,该研究报道了 tropolonic 倍半萜生物合成中的分子间杂原子 D-A 反应,并且对真菌中第一个分子间杂原子 D-A 环化酶 EupfF 进行了功能表征。
▍研究内容
作者从微紫青霉野生型菌株中分离到 1 和 3 两个化合物,随后通过对微紫青霉菌基因组的生物信息学分析,发现了唯一的一个 trop-like NR-PKS 基因簇。
为了鉴定 neosetophomone B(1)的生物合成途径,作者在构巢曲霉中异源表达了 eupf 基因簇,首先将 eupf ABC 在构巢曲霉中异源表达,得到了主产物 stipitaldehyde (4, 图 3a),随后从 cDNA 文库中克隆出短链脱氢酶 eupf E(无内含子)在大肠杆菌中异源表达,将其纯化出来后进行体外酶活实验(图 3b)
4 + NADPH,没有生成新化合物。4 + NADPH + eupf E,4 完全转化为新化合物 5。
不稳定的化合物5可能自发或经过酶催化转变成tropolonic-邻亚甲基苯醌。
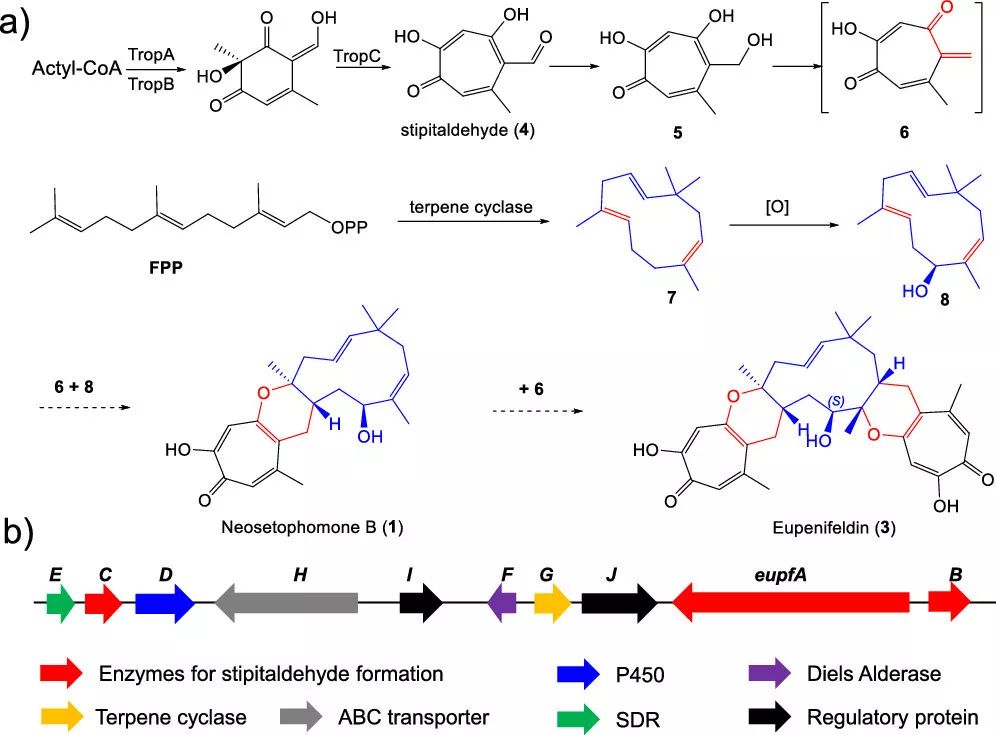
图 2. (a)1 和 3 的生物合成途径,(2)微紫青霉菌中 Eupf 基因簇的组成
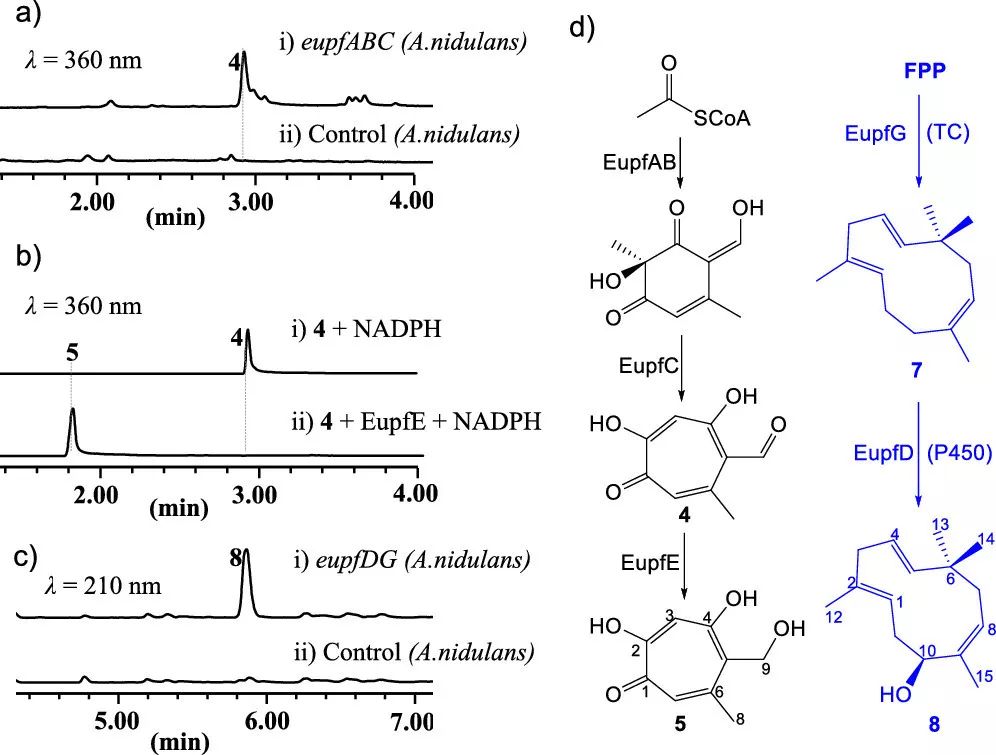
图3. 1 的生物合成过程中潜在前体的生成
作者发现,5 的 C9 位的羟基会被甲基化,甲基化的 5 被鉴定为是一对 2:1 的互变异构体混合物(6),由于从 5 转化为 6 并不完全,因此作者猜测该过程需要杂原子 D-A 环化酶 EupfF 的参与。但是作者无法纯化得到可溶的EupfF。幸运的是,作者从 Phoma sp.的基因组中发现了一个与 EupfF 高度相似的酶 EupF(81%),将 EupF 在大肠杆菌中异源表达之后,在体外进行了酶活验证,实验结果证明了之前的猜想:5 转化为 6 可以自发进行,但是杂原子 D-A 环化酶 EupF 将会显著加快反应速率。
随后,作者通过体外酶活实验证明了 EupF 可以直接参与杂原子 D-A 反应。有趣的是,作者发现当天然底物 8 被转化为非天然底物 humulenol(10) 时,该底物是通过喂养 humulene(9) 而获得的,在体外 EupF 实验中,通过喂养 humulene(9)得到了产物 2 和 11(1:1的比例)(图4a)。
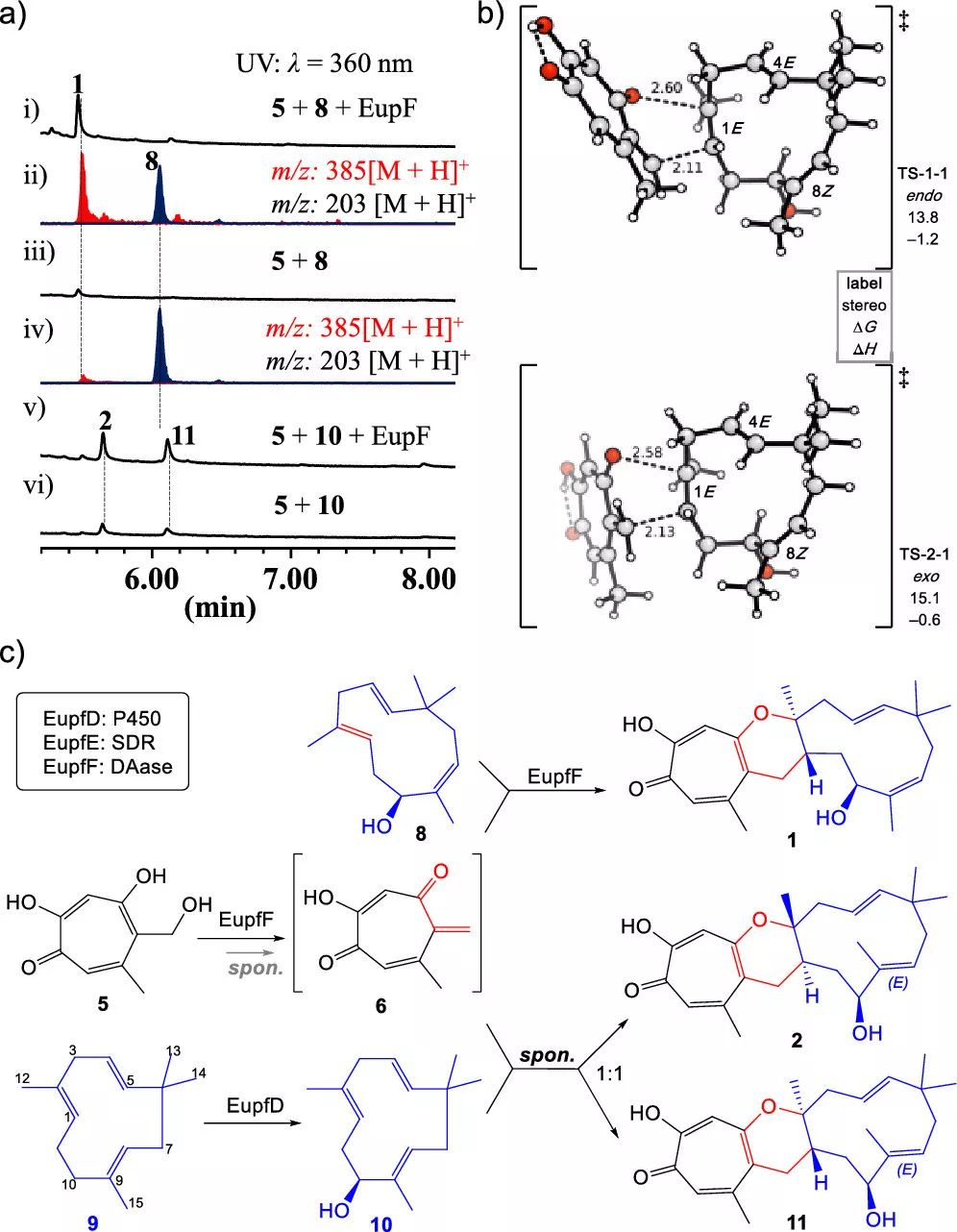
图4. 1 和 2 的生物合成
因此作者认为:
(1) 6 和 8 或 10 的环化反应是自发进行的(2) EupF 直接控制 hDA 反应的立体选择性(3) EupF 不识别非天然底物 10,但与 6 自发发生杂原子 D-A 环加成反应。
因此,EupF 被鉴定为是第一个分子间杂原子 D-A 环化酶,作者也用密度泛函理论(DFT)计算证明所推测的合成途径是容易进行的。遗憾的是,作者并没有通过体外酶活实验获得化合物 3,说明化合物 3 右侧的 D-A 反应需要其他的加成酶参与。
▍研究结论
综上所述,作者表征了第一个真菌分子间杂原子 D-A 环化酶EupfF(EupF),证明了 EupfF 催化了反应性的 tropolonic-邻亚甲基苯醌的生成,并立体选择性地控制了随后的分子间杂原子 D-A 环加成反应生成 1。作者的发现扩大了真菌中不断增长的D-A环加成酶的数量,为tropolone-倍半萜类化合物的挖掘和组合生物合成开辟了一条新的途径。
撰文:李鸿成
责编:李鸿成


点击“阅读原文”,即可下载文章