1、试验药物信息
本此临床试验用药DZD9008是迪哲(江苏)医药有限公司研制的一种口服的、不抑制野生型的EGFR选择性抑制剂,用于治疗EGFR和HER2基因携带外显子20插入突变或其他驱动突变的非小细胞肺癌患者。
中国医学科学院北京协和医院药物临床试验伦理委员会已于2019-08-06同意通过了该临床试验伦理审查。
2、试验目的
评估DZD9008在EGFR或HER2突变的晚期非小细胞肺癌患者中的安全性和耐受性,确定最大耐受剂量和推荐的二期研究剂量。
3、试验设计
试验分类: 安全性
试验分期: I期
设计类型: 单臂试验
随机化: 非随机化
盲法: 开放
试验范围: 国内试验
招募人数:15-30人
试验药与用药方案
名称用法1DZD9008(DZ0586)片片剂;规格50mg 。口服,每日一次,每次50 mg,用药时程:连续用药直至疾病进展,或发生不可接受的毒性,或患者要求退出临床试验,或出现方案规定的其他治疗终止事件。2DZD9008(DZ0586)片片剂;规格100mg 。口服,每日一次,每次100 mg,用药时程:连续用药直至疾病进展,或发生不可接受的毒性,或患者要求退出临床试验,或出现方案规定的其他治疗终止事件。3DZD9008(DZ0586)片片剂;规格100mg 。口服,每日一次,每次200 mg,用药时程:连续用药直至疾病进展,或发生不可接受的毒性,或患者要求退出临床试验,或出现方案规定的其他治疗终止事件。4DZD9008(DZ0586)片片剂;规格100mg 。口服,每日一次,每次300 mg,用药时程:连续用药直至疾病进展,或发生不可接受的毒性,或患者要求退出临床试验,或出现方案规定的其他治疗终止事件。5DZD9008(DZ0586)片片剂;规格100mg 。口服,每日一次,每次400 mg,用药时程:连续用药直至疾病进展,或发生不可接受的毒性,或患者要求退出临床试验,或出现方案规定的其他治疗终止事件。 对照组用药
无
4、入排除标准
入选标准
1 患者须理解临床试验的要求和内容,并在临床试验、样本采集、分析前提供带有手写签字和备注时间的知情同意书。
2 年龄 ≥ 18 岁。
3 患者须有经组织病理或细胞学确诊为局部晚期或转移的非小细胞肺癌的记录。EGFR或HER2突变类型经当地检测中心检测确定。
4 患者需在过去的两周内无疾病恶化且按美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)标准评分为0-1。
5 预测生存期 ≥ 12 周。
6 存在可经RECIST 1.1评估的病灶。
7 经过充分的标准治疗后进展或对标准治疗不能耐受。
8 有脑转移的患者可在以下条件下纳入至本研究:脑转移稳定,无神经系统症状且无需皮质类固醇治疗。如患者的脑转移已经手术治疗或放疗,则在首次给药DZD9008前需 ≥ 2 周的时间窗,以确保放疗或手术治疗的相关不良事件已降至 ≤ 1级。
9 器官系统功能较正常:
10 有女性伴侣并有生育意愿的男性患者应在同意参与临床试验研究期间至最后一次给药后的6个月内使用屏障避孕法(如使用安全套)。男性患者在参与临床试验期间至最后一次给药后的6个月内不可捐精。如男性患者有生育要求,建议在开始临床试验前冷冻精子。
11 女性患者在临床试验开始前至最后一次给药的6周内应采取避孕措施、不能进行母乳喂养、临床试验开始前验孕测试为阴性。
排除标准
1 在筛选前4周内,曾使用EGFR或HER2抗体治疗
2 在筛选前14天内,接受过任何细胞毒性化疗、仍在临床试验中的药物治疗或其他临床试验的抗肿瘤药物治疗
3 在筛选前4周内的重大手术(除建立血管通道)
4 在筛选前1周内曾行局部放射缓解治疗,如患者接受超过30%的骨髓放疗或大范围放疗须在筛选前4周内完成。
5 在筛选前2-3周内正在接受(或无法停止使用)可能的强效CYP3A抑制剂或CYP3A的诱导剂药物治疗或草本补充剂(例如St John’s wort 需要停药3周) 。
6 在筛选前一周内食用葡萄柚、葡萄柚汁,或者塞莉维亚橙汁(Seville orange)可能导致小肠内CYP3A4蛋白减少。
7 在筛选前4周内接受任何肿瘤免疫治疗(如PD-1,PD-L1,CTLA-4)。其他新型临床试验药物则需研究者及临床试验医师共同评估以确定是否可以入组。
8 在开始筛选前,因前期治疗引起的经CTCAE评估为大于1级的不良事件(脱发除外)。
9 存在脊髓压迫症或脑膜转移的患者。
10 存在严重或无法控制的系统性疾病,包括控制不良的高血压,出血性疾病,经研究者评估认为无法进行临床试验或可能缺乏临床试验的依从性,目前仍处于活跃期的感染包括乙肝、丙肝及人类免疫缺陷病毒感染(HIV) 。
11 以下任何心脏相关疾病:静息状态下心电图示校准后QT间隔(QTcF) > 470 ms;
12 静息状态下心电图显示心率、传导或图形的任何严重异常,如完全左束支阻滞、三级心脏阻滞、二级心脏阻滞、PR间期 > 250 ms
13 任何因素可引起QTcF延长或心率失常疾病,如心衰、低钾血症、先天性QT延长综合征、有QT延长综合征家族史或其他40岁以下猝死疾病家族史或其他已知引起QT间期延长的疾病
14 既往史有间质性肺病、药物引起的间质性肺病、需类固醇激素治疗的放疗性肺炎或任何临床症状活跃的间质性肺病
15 难治性恶心及呕吐、慢性胃肠道疾病、吞咽药物困难或曾行肠切除术以致无法充分吸收DZD9008
16 对DZD9008或相应类型的药物或其辅料有高敏感性
17 正在哺乳或怀孕的女性患者
18 参与本项研究的设计、计划或执行(适用于迪哲医药的员工或在研究中心的员工)
19 其它情况经由研究者判定患者不太可能遵循临床研究试验的过程、限制及相关要求,则患者不应参与本研究。
5、研究者信息
机构名称PI城市1中国医学科学院北京协和医院王孟昭北京2北京肿瘤医院方健北京 欢迎申办方/CRO/医院提供患者招募信息,本公众号免费发布。
患者(家属)可以联系咨询相关招募信,免费联系帮忙联系医院和申办方。

(扫码添加微信联系)

背景知识:
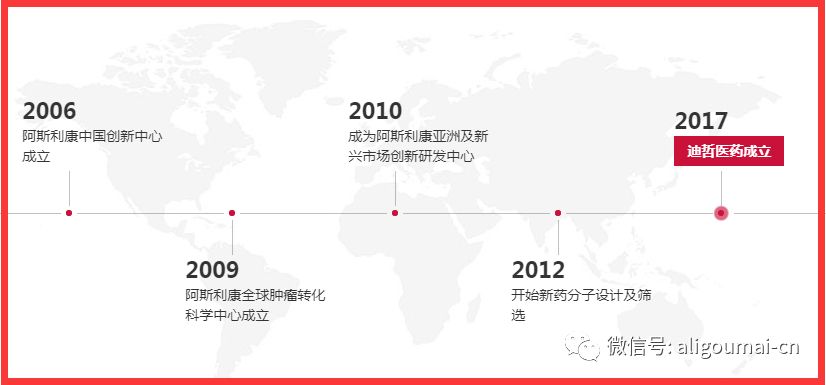
迪哲医药,于2017年10月独立运营,是一家研发驱动型生物医药企业,致力于全球创新药物(First-in-class/ Best-in-class)探索、研发以及商业化。
迪哲医药的前身为阿斯利康亚洲及新兴市场创新研发中心,设立于中国上海,是阿斯利康全球四个研发中心之一(另三个中心分别位于英国剑桥、瑞典哥德堡、美国盖瑟斯堡);是国际一流、高产出的创新药研发机构,拥有全球领先的转化医学和新药分子设计与筛选技术平台;在恶性肿瘤、自身免疫性疾病、肾病等重大疾病的新药研究方面积累了丰富经验。
哈佛癌症中心临床试验公益宣传片: