文章来源:艾美达行业研究
作者:Andrew
FDA10月8日宣布,批准Clinuvel公司开发的Scenesse(afamelanotide)上市,治疗因红细胞生成性卟啉病(erythropoietic protoporphyria,EPP)而出现皮肤损伤的成年患者,降低他们曝露在阳光下时可能出现的皮肤疼痛和损伤。Afamelanotide是全球首个获得监管批准用于治疗EPP患者提供系统性光保护作用以预防光毒性的药物。
说卟啉症可能一般人没有什么感觉,吸血鬼症可能会有些认知,而看过电影《心理罪》(李易峰版)的朋友可能会有比较鲜明认识。
Afamelanotide是一种合成的十三肽,4、7位取代α-促黑素细胞激素,其结构如图1所示。

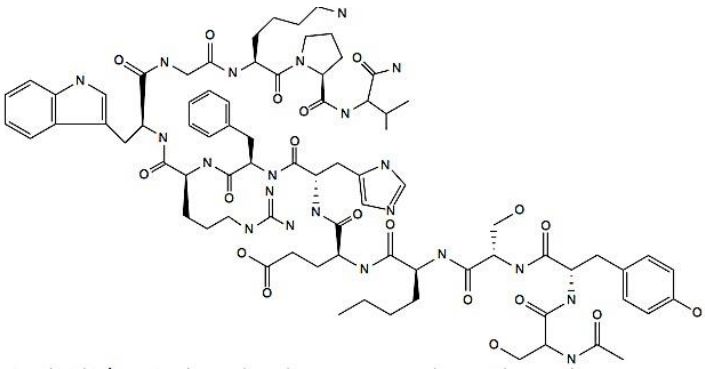
图1
笔者研究其专利发现,Clinuvel公司仅于2005年曾在中国申请了2个Afamelanotide的相关专利,但在2010年撤回了,也就是说,这款在美国刚刚上市的新药在中国没有专利保护!
更加深入了解,这不是Afamelanotide首次获批上市,其首次获批上市时间是2010年5月,在意大利,其后2014年在欧洲获批EPP适应症。也就是说该药上市近十年,在中国又无专利保护却无人问津!
分析原因可能有以下几点:
第一,虽然afamelanotide属于化药,但合成多肽难度大、成本高,受研发、生产实力所限,国内能够上市多肽类产品的企业着实不多,有实力的企业又大多数盯着大品种。
第二,注册分类政策的变化,让大部分企业对于已在国外上市而在国内没有专利保护的药品踌躇不已,一方面是相比于4类药品的临床难度大、费用高昂,另一方面是原来的4年监测期(独占期)没有了,药品刚上市就面临仿制竞品的威胁,对于现阶段面对一致性评价尚有选择困难的企业来说着实没有什么吸引力。
第三,过去国内生物医药行业对罕见病机会没有重视,销售上没有市场,政策上没有支持,企业自然没有动力。
第四,国内企业的研发风向一般还是以FDA的审批为风向标,虽然afamelanotide已上市近十年,但FDA却迟迟不批,也让国内企业心理没底,不敢过早投入。
以上几点大概是afamelanotide上市近10年却在中国无人问津的主要原因,但医药产业的发展终究要以满足临床需求为根本。
同为多肽的利拉鲁肽、艾塞那肽虽然目前未有国产品种获批上市,但已开展BE实验的分别已达8家、5家之多。查询国内上市的多肽产品,其进口、国产、专利到期时间如表1所示,7个专利已到期产品除利拉鲁肽、艾塞那肽外已经全部国产化,而格拉替雷的适应症多发性硬化症同样属于罕见病,其国内专利已于2017年到期,目前无进口产品,国内药企同样无人问津。

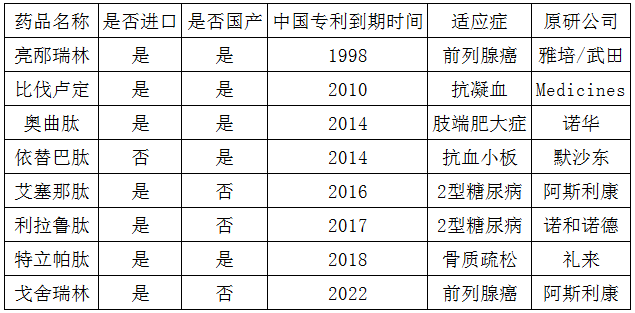
表1
2017年10月,中共中央办公厅、国务院办公厅发布了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,提出要“支持罕见病治疗药品医疗器械研发…罕见病治疗药品医疗器械注册申请人可提出减免临床试验的申请”,以加快罕见病药品医疗器械的上市审评审批。
2018年国家出台《第一批罕见病目录》,卟啉症、多发性硬化症赫然在列。
相信未来国家会在注册审批、监测期保护、市场准入、医保支付方法给予更多明确的支持,以打消对研发“孤儿药”持观望态度企业的顾虑。
2018年10月中国罕见病联盟成立,该联盟是经国家卫健委医政医管局同意,由北京协和医院、中国医药创新促进会、中国医院协会、中国研究型医院学会共同发起,50余家具有罕见病相关专科的医疗机构,以及高等院校、科研院所、企业等,自愿联合组成的全国性、非营利性、合作性的交流平台。
2019年10月19日,由中国罕见病联盟主办,中国医院协会、中国医药创新促进会、北京协和医院、中国研究型医院学会联合承办的“2019年中国罕见病大会”在北京举行。国家卫生健康委员会副主任王贺胜,十三届全国人大教科文卫委员会副主任委员、中国医院协会会长刘谦,国家医疗保障局副局长李滔,国家药品监督管理局副局长徐景和等出席大会并讲话,北京协和医院院长、中国罕见病联盟理事长赵玉沛院士发表了书面致辞,中国罕见病联盟执行理事长李林康主持大会开幕式。
中国罕见病联盟的成立代表着我国最具实力的一批医疗机构对罕见病的重视,研发罕见病治疗药成为获得高层次临床资源难得的机会,高层次的临床资源其价值不言而喻,而高层次医院同样是罕见病治疗药的最大市场。
据文献报道红细胞生成性卟啉病日本的发病率为十万分之四,如果同为黄种人的中国以此发病率计算,则我国患者约6万人,以人均年治疗费用20万计算(据报道,国外年治疗费在56404和84606欧元之间),市场容量为120亿,市场潜力巨大。
国家层面从注册审批到市场准入、再到医保支付,偏向鼓励解决临床治疗手段缺乏的品种,首仿上市afamelanotide无论是标准制定还是市场先机,里子面子都会有,期待未来更多罕见病新药、首仿药在国内上市。
*声明:本文由作者撰写,观点仅代表作者本人,不代表艾美达行业研究立场。本公众号内容仅出于传递更多信息之目的。