集赞送书活动详见标题六【集赞赠书】;感恩回馈,报二送一,限额220人!

注射剂一致性评价关键技术、现场检查及申报资料撰写实战经验分享研讨班
时间:2019年11月 09日~11日(2.5天)
地点:上海张江(酒店名称单独发报名老师)
邀请函

各制药领域同仁:2019年国家药监局在《化学仿制药参比制剂目录(第二十一批)》中首次发布了注射剂参比制剂,目前参比制剂目录已经发布到第二十四批,随着注射剂参比制剂不断明确,2019年后的2-3年将迎来注射剂一致性评价申报高潮。但近年来不断提升标准的药政法规及审评要求始终困惑着许多制药企业。为此,药研应广大制药领域同事要求,再次组织包括富有检查、审评、研发、注册、迎检经验的强大专家团队为大家带来一场注射剂开发盛宴!
本次研讨班由国内资深专家孙亚洲老师、范小娜老师(国家药监局检查员)、南方某省局稽查老师(国家药监局检查员)、张芳芳老师、陈洪博士、俞辉老师、国内某知名制药企业研发中心负责人等老师领衔主讲,会前还有其他知名专家陆续加入到本次培训盛会!专家老师们分别从注射剂处方和工艺研究、研制和生产现场检查、质量和稳定性研究、杂质研究与控制、注射剂无菌研究与质量控制、注射剂原辅包研究、相容性研究、申报资料撰写等多个主题进行系统深入的培训和经验分享。期待为从事仿制药研发和一致性评价的行业同事带来宝贵经验和帮助!
主办单位
药 研
支持/协办单位
天津市天大天发科技有限公司
北京北研科仪仪器有限责任公司
美国贝克曼库尔特商贸(中国)有限公司
上海博志研新药物技术有限公司
广州佳鑫医药科技有限公司
诺和医药科技沧州有限公司
【持续招募中】
支持媒体
Insight数据库 药智网 蒲公英
汇聚南药 药渡 丁香园 药时代 米内网
冠勤医药 巍信 新浪医药 新药汇 小木虫
一课程结构及培训议程
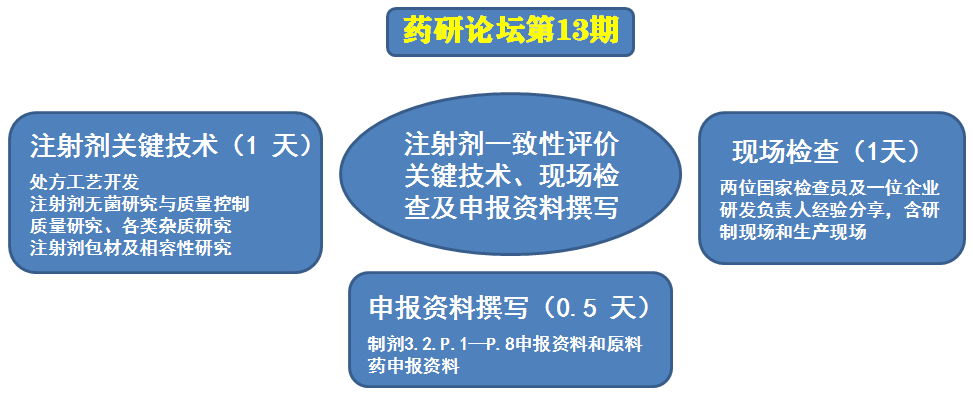
2019年11月09日(第一天)
08:30-10:00
(1.5小时)
主题:注射液再评价质量研究重点内容解析
一、注射剂剂型特点及质量要求
二、注射剂对API及辅料的质量要求
三、注射剂杂质特点,研究与控制策略
四、一般杂质限度拟定的基本思路与策略及案例分析
五、基因毒性杂质研究思路及控制策略
六、警示结构杂质研究思路及控制策略
七、金属杂质研究思路及控制策略
八、溶液的颜色
九、不溶性微粒
十、可见异物
十一、溶液的澄清度等问题
十二、注射剂稳定性研究
十三、答疑
报告嘉宾:周立春 原北京市药品检验所抗生素室主任、生化实验室主任及所长助理。药典委员会委员、国家食品药品监督管理局审评专家库专家。
10:00-10:20
(20分钟)
茶歇
10:20-11:50
(1.5小时)
主题:仿制药一致性评价制剂和原料申报资料撰写及注意事项(制剂资料为主)
1、3.2.P.1剂型与产品组成
2、3.2.P.2产品再评价研究
3、3.2.P.3生产信息
4、3.2.P.4原辅料的控制(重点介绍原料药申报资料撰写及注意事项)
5、3.2.P.5制剂的质量控制
6、3.2.P.6对照品
7、3.2.P.7包装材料
8、3.2.P.8稳定性
报告嘉宾:周立春 原北京市药品检验所抗生素室主任、生化实验室主任及所长助理。药典委员会委员、国家食品药品监督管理局审评专家库专家。
11:50-12:00
(10分钟)
答疑
12:00-13:30
(1.5小时)
午餐
13:30-15:00
(1.5小时)
主题:仿制药质量和疗效一致性评价现场检查要点及案例分析(一)
一、研制现场核查要点
1.《仿制药质量和疗效一致性评价研制现场核查指导原则》法规解析
①处方工艺研究与样品试制
②药学研究与体外评价
③委托研究
2. 迎检自查关注要点
①迎检文件清单、首次会议企业汇报PPT;
②现场管理
二、生产现场检查要点
1.《仿制药质量和疗效一致性评价生产现场检查指导原则》法规解析
①处方、工艺与设备和现场的一致性:
②现场物料系统管理
③生产系统管理
④QC和QA系统
⑤数据可靠性
报告嘉宾:范小娜 原北京市药品监督管理局稽查处、国家药监局现场检查员
15:00-15:20
(20分钟)
茶歇
15:20-16:20
(1.0小时)
主题:仿制药质量和疗效一致性评价现场检查要点及案例分析(二)
2. 迎检自查关注要点
①迎检文件清单、首次会议企业汇报PPT
②现场管理及动态生产现场准备
3. 化学仿制药注射剂一致性评价生产现场检查要点
①机构和人员
②厂房设施与设备
③物料与产品
④批量生产过程
⑤质量控制与质量保证
三、案例分析及分享
1.固体制剂检查案例分析
2.化学仿制药注射剂检查案例分析
报告嘉宾:范小娜 曾任职于北京市药品监督管理局稽查处、国家药监局现场检查员
16:20-17:50
(1.5小时)
主题:注射剂一致性评价元素杂质的风险评估和控制
1.法规对元素杂质控制要求的来龙去脉?
2.什么产品什么时候进行元素杂质的控制?
3.注射剂没有加入元素杂质也要做风险评估吗?
4.无机元素杂质限度是怎么订的?
5.元素杂质的控制必须定入产品的质量标准中吗?
6.注射剂内包材必须做可浸出的(leached)元素杂质研究吗?
7.无机元素杂质必须用ICP-MS检测方法吗?
8.怎样采用USP<233>方法对无机元素杂质进行检测?
9.怎么确认USP<233>方法以及自研方法的验证?
10.需要准备哪些元素杂质控制的文件来满足注册的要求?
演讲嘉宾:陈洪 博士、成都苑东生物副总经理、原Teva分析总监
17:50-18:00
(10分钟)
答疑
2019年11月10日(第二天)
08:30-10:00
(1.5小时)
主题:仿制药一致性评价药学研制现场和生产现场检查要点和常见问题对策(一)
1、仿制药一致性评价药学研制和生产现场检查的法律依据
2、在药品注册的各阶段检查的目的
3、药品注册现场核查/检查的主要内容
4、药品注册研制现场药学部分核查
5、药品注册研制现场核查常见问题及对策
6、仿制药质量和疗效一致性评价研制现场核查
7、药品注册生产现场核查
8、药品注册生产现场核查常见问题及对策
9、仿制药质量和疗效一致性评价生产现场检查
报告嘉宾:南方某省药监局稽查处、国家药监局现场检查员
10:00-10:20
(20分钟)
茶歇
10:20-11:50
(1.5小时)
主题:仿制药一致性评价药学研制现场和生产现场检查要点和常见问题对策(二)
1、仿制药一致性评价药学研制和生产现场检查的法律依据
2、在药品注册的各阶段检查的目的
3、药品注册现场核查/检查的主要内容
4、药品注册研制现场药学部分核查
5、药品注册研制现场核查常见问题及对策
6、仿制药质量和疗效一致性评价研制现场核查
7、药品注册生产现场核查
8、药品注册生产现场核查常见问题及对策
9、仿制药质量和疗效一致性评价生产现场检查
报告嘉宾:南方某省药监局稽查处、国家药监局现场检查员
11:50-12:00
(10分钟)
答疑
12:00-13:00
(1.0小时)
午餐
13:00-14:30
(1.5小时)
主题:仿制药一致性评价经验分享——项目研发及管理
1. 首仿成功的经验分享及关键要素分析;
2. 项目研发及管理经验及案例分析;
3. 仿制药开发与管理建议
4.答疑
报告嘉宾:国内某知名制药企业研发中心负责人
14:30-14:50
(20分钟)
茶歇
14:50-16:20
(1.5小时)
主题:注射剂一致性评价包材研究及质量控制
1.药包材的范畴和法律地位
2.药包材的法规介绍和注册范围
3.药包材的组件和系统
4.高风险药品包装的概念和特点,
5.高风险药品包装的形式和质量关键属性
6.常用药品包装材料的灭菌方式
7.不同灭菌处理方式的条件和优缺点
8.选择药品包装材料的原则
9.高风险包装的设计,风险评估和要求!
10.包材相容性研究
11.答疑
报告嘉宾:俞辉 浙江省食品药品检验研究院药品包装材料所所长
16:20-17:50
(1.5小时)
主题:注射剂一致性评价中包材质量控制与研究
一、注射剂包材的分类
二、注射剂一致性评价对药包材的要求
三、注射剂包装的质量要求
四、注射剂与药包材的相容性
五、注射剂包装容器的密封完整性
六、答疑
报告嘉宾:张芳芳 上海市食品药品包装材料测试所高级工程师、检验部门副主任
17:50-18:00
(10分钟)
答疑
2019年11月11日(第三天)
08:30-10:00
(1.5小时)
主题:注射剂的处方前研究和处方工艺开发
一、不同剂型注射剂对API的质量及合成路线的要求
二、API化学结构和理化性质与注射剂剂型选择、灭菌方式的相关性
1、真溶液型注射剂
1.1可终端灭菌注射剂
1.2无菌生产注射剂
2、注射用冻干类注射剂
3、注射用无菌粉末分装类注射剂
三、处方前研究及处方工艺开发其案例分析
1、API稳定性
2、晶型、粒径及分布与溶解度及速率
3、粉体特性、吸湿性及稳定性
4、辅料特性研究
5、原辅料相容性试验
5.1、目的、前提及设计原则等
5.2、原、辅料之间的化学作用及原因
5.3、测定项目选择
5.4、原辅料的比例
5.5、原辅料相容性试验研究易出现的主要问题
报告嘉宾:孙亚洲 湖南晶易医药科技/北京亚欣保成医药科技有限公司主要创始人、CFDA高级研修学院特聘讲师
10:00-10:20
(20分钟)
茶歇
10:20-11:50
(1.5小时)
主题:注射剂一致性评价的再立项评估、技术要求、处方工艺开发要点和案例分析
一、注射剂一致性评价国家政策的发布及重大意义
二、一致性评价技术要求的发布和解读
1、政策发布
2、注射剂的分类及选择依据
3、与立项评估有关政策及解读
4、与三改品种有关的相关内容及解读
4.1改规格注射剂
4.2改剂型注射剂(小水针改冻干、冻干改小水针或大输液、小水针和大输液的互改、改盐基等)
5、重大变化解读
5.1处方工艺及质量评价(处方、工艺等)
5.2活性炭及去除后产品工艺开发和质量控制要点
5.3工艺过程中使用滤器、硅胶管、塑料器具等的相容性研究(药液与滤器、药液与硅胶管等直接接触的容器等)
5.4、金属离子和基因毒杂质
5.5玻璃包装容器
5.6 配伍稳定性研究
5.7、生产批量
报告嘉宾:孙亚洲 湖南晶易医药科技/北京亚欣保成医药科技有限公司主要创始人、CFDA高级研修学院特聘讲师
11:50-12:00
(10分钟)
答疑
二讲师信息
排名不分先后

孙亚洲
湖南晶易医药科技/北京亚欣保成医药科技有限公司主要创始人
CFDA高级研修学院特聘讲师,副研究员,湖南省试验动物中心(GLP评价中心)副主任兼药学部负责人。在药品研发立项、原料药、制剂及质量研究均具有丰富经验。具备60余个产品从实验室、中试、移交到大生产的注册、试生产全过程的研究经历,且大部分已成果转化为生产或临床批件。

老师国家药监局检查员、南方某省药监局稽查处

范小娜 国家药监局检查员、曾任职北京市药品监督管理局稽查处原北京市药品监督管理局稽查处任职、国家药监局检查员、检查组长。对疫苗、血液制品、原料药、注射剂、固体制剂等企业进行过多次GMP认证、跟踪、飞行检查和药品注册现场检查。

周立春
原北京市药品检验所抗生素室主任、生化实验室主任及所长助理/药典委员会委员、国家食品药品监督管理局审评专家库专家
在药品检验一线工作30余年,曾任北京市药品检验所抗生素室主任、生化实验室主任及所长助理。第九、十及第十一届药典委员会委员、国家局CDE仿制药立卷审查组成员,北京市上市后药品安全性监测与再评价专家库专家,国家食品药品监督管理局等多个机构审评专家库专家。

张芳芳
上海市食品药品包装材料测试所高级工程师,检验部门副主任
参与多项食包材、药包材、药用辅料质量标准制修订,曾承担/参与上海市局多项包材研究课题。2015-2016年曾赴美国可提取物浸出物实验室进修。参与翻译《欧美日药典药包材标准选编》,发表及参与专业论文10余篇,申报发明专利2项、参与实用新型专利1项等。

国内某知名制药企业研发中心负责人,具备一致性评价成功申报经验

陈洪
博士、成都苑东生物副总经理、原Teva分析总监
1991 年赴美国留学,后获得了美国克利夫兰州立大学分析化学专业博士学位,被美国克利夫兰医学中心聘为生物医药专业博士后研究员。自 1998 年开始到 2015年3 月一直在美国从事药物研发工作。他先后在新一代制药公司、强生制药和Teva制药公司等国际知名制药企业的研发部门担任分析研发总监等职务,他领导和主持开发的药物有十余个通过 FDA 批准上市。2015年回国后曾任以岭药业化药研究院院长,主持和带领研发团队申报包括国内一致性评价和ANDA项目在内的多个品种,BE全部一次性通过。在化药研发方面,他具有深厚的理论知识及实践、丰富的国际化药研发和科研管理经验。

俞辉(待定)
浙江省食品药品检验研究院药品包装材料所所长
现任国家食品药品监督管理局浙江药品包装材料检验中心、浙江省食品药品检验研究院药品包装材料所所长、浙江省药品接触材料质量控制研究重点实验室副主任、主任药师。任第九、第十和第十一届国家药典委员会委员、国家新药审评咨询专家委员会委员、中国现代应用药学杂志社第六届编委、药物分析杂志编委、国家食品药品监督管理局药品包装材料技术审评专家、浙江省医药包装行业协会常务理事和秘书长等职。
三时间、地点
1.时间:2019年11月9-11日(8日下午14:00~18:00及9日早07:40~08:30签到)。
2.地点:上海张江,地铁2号线张江高科附近,具体酒店地址将单独发给参会老师
四培训对象
制药企业、研发机构中从事药品研发、注册申报、项目管理人员、法规人员、制剂研发、CRA、立项人员;大专院校、科研院所的老师和学生;药监体系审评、检查人员等。
五会议报名
1.报名:名额有限,额满为止!

长按二维码预报名
2.报名费:为答谢广大制药领域同仁长期以来对药研论坛的支持和信任,本次研讨班在不降低培训质量的前提下降低收费标准,以特惠班形式期待为更多同仁带来帮助!,限额220人,额满为止!
即日起至10月31日缴费:2500元/人(报2再送1,约1666元/人);
11月1日-11月5日缴费:2800元/人(报2再送1,约1866元/人);
11月6日至现场缴费:3200元/人(报2再送1,约2133元/人)。
10人以上组团报名享受更多优惠。
费用包括:培训费、会议资料费、证书费、午餐和茶歇等(可开具增值税普票或专票)。
3.缴费方式
户名:诺和医药科技沧州有限公司
账号:0408010809300138975
开户行:中国工商银行沧州福宾支行
如个人账户缴费,请付至微信/支付宝:15911172616
4.会务咨询
刁老师:手机15911172616
邮箱:15911172616@qq.com
微信:diaodiao666666

六集赞赠书
1.参会人员
参会即送奖品1-5(奖品6-12可通过集赞赠书活动获取任意两件),奖品如下:
奖品1.药研升级版32G优盘2个(USB3.0超高速版)奖品2.CDE等审评老师在2018年-2019年10月发表的精选文章电子版合集70+篇奖品3.药研国际注册主题研讨班电子版讲义(共5个)奖品4.药研口服固体制剂一致性评价主题研讨班电子版讲义(共10个)奖品5.2019最新版ICHQ1-Q12全系列中文电子版书籍(2019最新书签版,约700页)奖品6-12可通过下述【集赞赠书】活动获取任意2件,
即日起凡缴费参加本次培训人员,可通过下述两种方式中的任一方式获取纸质书籍或其他奖品:方式一:将本培训信息分享至朋友圈集满36个赞;方式二:转发至3个(含)以上制药微信群(分享转发2小时后截图),并于11月5日23:59前在下方二维码上传截图的,均将在培训结束后7日内免费获得以下奖品(共7种奖品,7选2):奖品6.2019最新版ICHQ1-Q12全系列中英文纸质版资料一套(2本约800页)
奖品7.2019最新版ICHM4CTD通用技术文档中英文纸质版资料一套(1本约300页)
奖品8.2019ICHM7基因毒性杂质中英文纸质版资料一套(1本约150页)
奖品9.2019计算机化系统验证和数据完整性指南中英文纸质版资料(2本约500页)
奖品10.2019最新版CEP/COS欧洲药典适用性认证指南中英文纸质版合集(2本约400页)
奖品11.2019最新OMCL官方药品控制实验室-质量管理文件中英文纸质版(2本约500页)
奖品12.2019FDA药物CGMP现场检查警告信中英文纸质版(1本约400页)

(参会人员集赞截图上传入口)
2.非参会人员即日起凡制药领域同事,可通过下述两种方式中的任一方式获取电子资料:方式一:将本培训信息分享至朋友圈集满36个赞;方式二:转发至3个(含)以上制药微信群(分享转发后不可删除和撤回),并于11月5日23:59前在下方二维码上传截图的,均将在11月15日获得以下奖品(共4种奖品,4选3):
奖品1.CDE等审评老师在2018-2019.09发表的精选文章电子版合集20篇奖品2.药研国际注册主题研讨班电子版讲义(共5个)奖品3.药研口服固体制剂一致性评价主题研讨班电子版讲义(共10个)奖品4.ICHQ1-Q12全系列中文电子版书籍(2019最新书签版,约700页)

(非参会人员集赞截图上传入口)
七招募合作单位
招募合作赞助单位/报告专家,提供企业展位、多媒体演示等多种合作方式,洽谈电话:15911172616
八鸣谢
感谢报告嘉宾、上述协办机构和媒体对本次会议的大力支持!
感谢欲将参会的各位企业代表长期以来对我们的信任和支持!
最后,感谢业界各位老师、朋友对本次会议提供的各项帮助!
九药研简介
药研论坛:药研公众号自2016年成立以来持续为业内提供药物研发、生产和注册相关信息,目前制药领域关注用户近5万人!药研主导的培训已筹办多期,截至2019年05月已为包括扬子江药业集团、石药集团、华北制药、华海药业、恒瑞医药、科伦药业、丽珠集团、香港澳美、东阳光、中国医学科学院、中国科学院、亚宝药业、上海强生、阿斯利康、山德士、远大集团、正大天晴、豪森药业、海正药业、天士力、以岭药业、成都倍特、陕西步长、北京协和、华润紫竹、华润双鹤、北京泰德制药、江苏先声药业、山东齐鲁、山东绿叶、仙琚制药等知名企业在内的750+企业和CRO提供了高质量的专业化培训,均收到良好效果,会后获得参会企业一致好评。已成为制药领域货真价实的高端培训品牌!
附1:往期培训盛况(含线下培训)即将开启:第13期【孙亚洲老师】注射剂一致性评价关键技术+现场检查+申报资料撰写第12期:祝贺药研论坛第12期【2019口服固体制剂CMC与BE研究关键技术解析与案例分享暨研发经理晋级实用性研讨班】圆满落幕!
第11期:热烈祝贺药研论坛第11期【仿制药一致性评价关键技术解析及全程申报资料、原始记录撰写与注册现场检查】研讨班圆满落幕!第10期:热烈祝贺药研论坛第10期【2019一致性评价及申报资料和原始记录撰写】研讨班圆满落幕!第8期:【终轮通知】2019药品申报中CMC分析文件的准备和案例分享及发补经验第7期:【药研培训】2018分析方法转移的国内外法规介绍与案例分析第6期:【圆满落幕】2018注射剂一致性评价关键技术与案例分析第5期:热烈祝贺【药研论坛第5期 注射剂一致性评价关键技术与案例分析】取得圆满成功!!第4期:【6月23日】王建英博士莅临2018欧美仿制药和原料药国际注册会议并作主旨报告
第3期:【终轮通知】制剂处方工艺和生物等效性(BE)试验管理及 一致性评价注册申报及迎检第2期:【北京·终轮通知】处方工艺研究及DoE培训参会企业名单及会议信息第1期:药研沙龙第一期活动公告(免费)
可点击左下角,“阅读原文”预报名